Entre los aspectos a valorar en el proyecto piloto por la empresa adjudicataria, la DG de Recursos Humanos y Servicios Económico-Presupuestarios del Ministerio de Sanidad ha elaborado “una lista no exhaustiva” en la que se encuentra, por ejemplo, la carga de trabajo humana. “Independientemente de la capacidad de realizar lecturas automáticas mediante la tecnología de marcaje oportuna, es importante no olvidar la intervención humana a lo largo del ciclo de vida de dicha identificación”, señala.
Otros aspectos son la complejidad en la implantación del marcaje en la cadena de suministro y comercialización, teniendo en cuenta “las particularidades y heterogeneidades de los agentes involucrados”; el coste económico; la facilidad de aplicación; la fiabilidad; el impacto en la calidad y seguridad del medicamento; el impacto medioambiental y condiciones de reciclaje; el rendimiento; y la seguridad, que garantice la autenticidad del marcaje.
Estos aspectos serán tenidos en cuenta por el equipo del proyectos, que estará compuesto por un Comité de Dirección (integrado por responsables de la DG de Farmacia, de la Subdirección General de Tecnologías de la Información y representantes de los tres agentes participantes), un Comité de Seguimiento (se excluye a los agentes del sector), y un equipo de trabajo de la empresa adjudicataria. En este sentido, cabe destacar que la DG de Farmacia informará de los avances a las CC.AA.
Por otro lado, resalta que en la segunda versión de este documento ha desaparecido un “aspecto clave”: las características del envase, que puede condicionar la facilidad de aplicación, lectura y opciones de ubicación del marcaje. Un aspecto que podría ser recogido en un anexo del documento final.
JUAN NIETO
Madrid
Las opiniones de la industria acerca de la presencia “innecesaria” de la distribución en el piloto para determinar el sistema de identificación automática más adecuado para llevar a cabo la trazabilidad de medicamentos, por entender que ésta puede llevarse de manera efectiva controlando el principio (la industria) y el final (oficinas de farmacia) de la cadena, han sido contrarrestadas por el Ministerio de Sanidad. El departamento de Bernat Soria sí cree necesaria la presencia de la distribución en este pilotaje, y así lo pone de manifiesto en el pliego de prescripciones técnicas del procedimiento abierto para llevarlo a cabo.
En este sentido, el documento sobre el que trabajan los responsables ministeriales y los representantes de industria, distribución y oficinas de farmacia es claro al indicar que “conviene establecer un mecanismo, de manera que los laboratorios farmacéuticos, los almaces mayoristas y las oficinas y servicios de farmacia efectúen, entre otras funciones, el seguimiento de cada lote y cada unidad de presentación de medicamento puesta en el mercado”.
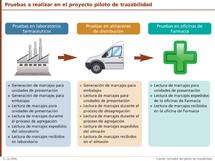
Asimismo, el documento especifica de una manera clara (ver tabla) las distintas pruebas, tanto no operativas como de generación de identificación, que deben realizar sobre cada uno de los dos sistemas propuestos, Datamatrix y radiofrecuencia, los tres agentes del sector. Entre estas pruebas, que implican a laboratorios, mayoristas y oficinas de farmacia, se encontraría la generación de marcajes y la lectura de los mismos. “El piloto debera determinar el sistema más adecuado en los diferentes puntos de entrada y salida de medicamentos, teniendo en cuenta los diferentes agentes de la cadena de suministros involucrados en el programa piloto”, dice.
Saltar los eslabones
La posible ausencia de la distribución en este piloto ha sido calificada por Antonio Mingorance, presidente de la patronal española de la distribución, Fedifar, como “una falta de sentido común y un disparate”. Según él, la presencia de la distribución en el proceso de trazabilidad es “imprescindible ya que, por ejemplo, el 80 por ciento de los fármacos que llegan a las oficinas de farmacia pasa antes por la distribución”.
A este respecto, señala que como representantes de la distribución española ya habían estado presentes, junto a responsables técnicos del ministerio, de Farmaindustria y del CGCOF, en un par de reuniones para establecer las líneas básicas sobre las que debe establecerse el pilotaje. Una prueba, según él, de que la distribución tiene mucho que decir en la implantación de un sistema de trazabilidad que sea un éxito.
Sin embargo, reconoció que si la pretensión de dejarles fuera respondía a “otras cosas”, estaba fuera de lugar. “Nosotros no nos decantamos por uno u otro, eso es algo que se debe decidir una vez obtenidos los resultados del pilotaje”, afirma. Sobre este aspecto se pronunció también el vicepresidente de la patronal, Lluís Barenys, al señalar que “es posible que la industria tenga otros intereses que no son estrictamente la trazabilidad”.
Para Barenys, lo importante es “tener voluntad y seriedad” a la hora de elegir un sistema adecuado que sea “el más fácil y barato de implantar”. En este sentido, consideró que el sistema elegido debería ser la radiofrecuencia y que, a pesar de los plazos establecidos para su puesta en marcha éstos deberían ser flexibles. “No me preocupan los plazos, lo que hay que hacer es empezar a trabajar todos con buena intención”, dijo.
Por su parte, el presidente del CGCOF, Pedro Capilla, durante una comparecencia en el Senado en el marco de la “Ponencia de estudio de las necesidades de recursos humanos del SNS”, se manifestó también abiertamente “a favor de la radiofrecuencia como sistema idóneo para poner en práctica la trazabilidad entre todos los agentes de la cadena del medicamento”.
El pilotaje
Respecto al pilotaje, Sanidad ya ha puesto fecha para recibir por parte de la empresa adjudicataria los resultados y conclusiones: a más tardar el 30 de septiembre de 2009. Una fecha que permitiría que el RD de Trazabilidad saliese a la luz ese año. Eso sí, el importe de la contratación para realizar el pilotaje, que correrá a cargo del Estado, no ha sido concretado.
Para Sanidad resulta imprescindible disponer de “un sistema transparente, fiable y ágil” que permita a las autoridades sanitarias reaccionar ante posibles riesgos detectados en la calidad y seguridad y para garantizar un “abastecimiento adecuado y continuado de los mismos a los ciudadanos”. Para ello, el pilotaje quiere “determinar y evaluar las cualidades de las dos tecnologías”, aunque deja claro que no es objeto del piloto “definir, diseñar o construir ningún sistema informático de cara a facilitar un intercambio, almacenamiento o búsqueda de información de los nuevos marcajes de medicamentos”.
Entre los requisitos exigidos se encuentra el de la identificación, que deberá ser individualizada y automatizada. Asimismo, la empresa adjudicataria contará con una lista de presentaciones de medicamentos (reales) que sirva de muestra suficiente para el estudio, y deberá cumplir unos requisitos tecnológicos: codificación de envases, lectores fijos, móviles, sistemas para generar la identificación, herramientas estadísticas para el análisis o la realización de las pruebas para la radiofrecuencia con UHF Gen2.