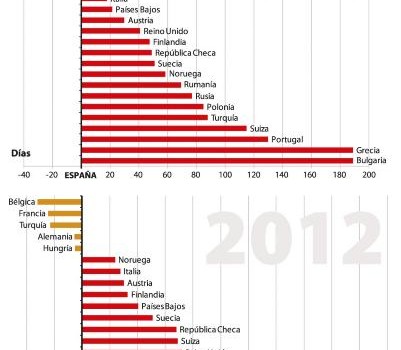
España mantuvo su posición en cuanto al tiempo para iniciar un ensayo clínico en oncología durante 2013 con respecto a los resultados cosechados el curso anterior. De esta forma sigue ocupando el sexto lugar dentro de los países europeos, solo superada por Francia, Bélgica, Irlanda, Alemania y Hungría, según los datos aportados por Farmaindustria a través del análisis del Proyecto BEST, que mide la calidad y la celeridad con la que se llevan a cabo los ensayos clínicos.
España realizó, según los datos recabados por el proyecto BEST, 588 ensayos correspondientes a oncología, lo que supuso un 31,8 por ciento de todos los ensayos llevados a cabo durante 2013. Asimismo, esta especialidad ha sido la única que ha crecido de manera constante dentro de las cuatro áreas principales donde se realizan ensayos clínicos (cardiovascular, neurociencias y antiinfecciosos, además de oncología), lo que muestra la importancia de mantener la posición privilegiada que ocupa España en los tiempos para iniciar los ensayos.
Los datos de Farmaindustria realizan una retrospectiva desde 2009 donde puede observarse una clara mejora que se ha consolidado en 2013. Sin embargo, y comparándonos con países vecinos como Francia, el margen de mejora existe. De los 190 días aproximadamente que tarda España en completar la fase de inicio de un ensayo clínico, Francia consigue hacerlos en 28 menos. De igual forma, Bélgica tarda 20 días menos, Irlanda 16, Alemania 14 y Hungría siete.
Otro de los datos que se usan para medir la calidad de los ensayos clínicos es la tasa de reclutamiento de pacientes. En el caso de la oncología, el dato está por encima de la media (80 por ciento) y se sitúa en el 82,6 por ciento. Con respecto a los datos recabados en 2012, esta tasa se ha incrementado en un dos por ciento pero, sin embargo, es uno de los puntos donde España más debe trabajar si se compara con el resto de países europeos, ya que ocupa el antepenúltimo lugar, solo por encima de Portugal e Irlanda.
Detalles del nuevo proyecto
Para mejorar los datos temporales y de reclutamiento de pacientes el Gobierno está ultimando el proyecto para la regulación de ensayos clínicos. Tras un primer borrador ya publicado, la Asociación de Medicina de la Industria Farmacéutica (Amife) ha realizado un análisis del mismo destacando las mejoras que introduce.
En este sentido, como primera novedad destacable, Amife señala “la necesidad de establecer un modelo de contrato único para la realización de ensayos clínicos, válido para todo el Sistema Nacional de Salud, así como la prohibición de fijación de tasas administrativas que no se encuentren bajo el amparo normativo establecido por cada una de las Comunidades Autónomas”. De esta forma, dicho contrato deberá suscribirse “entre cada centro participante y el promotor dentro del plazo máximo de 60 días naturales”.
Asimismo el proyecto pretende diferenciar entre dos partes en la evaluación del ensayo. La parte I, “donde se requiere la evaluación por la Aemps y que incluiría, entre otros, el análisis de la pertinencia del ensayo clínico así como de su diseño, los criterios de selección y retirada de los sujetos del ensayo, la justificación de la posología y los riesgos e inconvenientes previsibles”. Por otro lado, la parte II, cuya evaluación correría a cargo del Campus de Excelencia Internacional e incluiría, entre otros, “el examen de la idoneidad del investigador así como de las instalaciones en las que se realizará en ensayo, el cumplimiento de los requisitos relativos a la indemnización por daños y perjuicios y las previsiones de remuneración para los investigadores y sujetos del ensayo”.