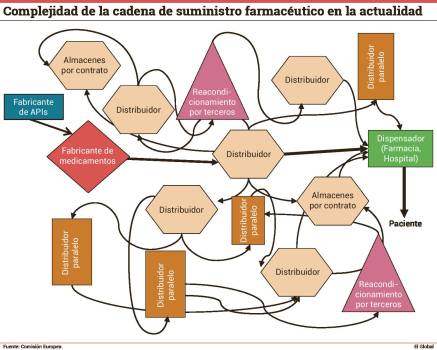
En octubre de 2016, la presidencia de Eslovaquia de la UE incluyó de forma decidida la continuidad del suministro de medicamentos en la agenda sanitaria europea. El punto de partida mostraba la disposición de los estados a colaborar en una materia que afecta a todos ellos, pero también su división en cuanto a si era necesario reexaminar el funcionamiento del mercado interno —lo que en la práctica también implicaba reabrir la discusión de si el medicamento debe o no ser considerado como un bien ordinario, y por lo tanto sujeto a las mismas normas de comercio que el resto—. Los ministros de Salud estuvieron de acuerdo en que la clave del éxito podía residir en un intercambio de información que permitiera mapear el mercado. Este mapa no ha hecho sino poner en evidencia lo que era un secreto a voces: que el suministro farmacéutico es un rompecabezas que de nuevo pondrá a prueba la capacidad de colaboración en la Unión Europea.
Atendiendo al llamamiento realizado tanto por el Consejo de Ministros de Salud de la UE como por el Parlamento Europeo, la Comisión Europea decidió monitorizar la implementación del artículo 81 de la Directiva 2001/83, que contempla las garantías del suministro, mediante un cuestionario que contestaron un total de 28 estados miembros (27 de la UE y Noruega). La primera conclusión que deja a su paso es que, si bien se trata de un asunto que preocupa a todos, cuando se habla de él cada uno bien podría estar hablando de algo diferente.
En Francia es la incapacidad de una oficina de farmacia o de una farmacia hospitalaria de dispensar un medicamento en 72 horas; en Rumanía es la disminución del stock nacional durante siete días consecutivos; Países Bajos distingue entre dos términos: “disrupción en el suministro”, si se refiere a los titulares de autorización de comercialización, o “escasez”, si lo hace desde la perspectiva del paciente. Sólo tres estados han incluido en su legislación nacional una definición específica de lo que es la falta de continuidad o el “desabastecimiento”, y esas definiciones no tienen nada que ver. Frente a ellos, otros cuatro estados disponen de clasificaciones en sus procedimientos internos (también variables) y el resto, la gran mayoría, no tienen ninguna definición específica.
Si vamos al paso previo, la transposición de la directiva, ya es posible detectar diferencias. Se ha llevado a cabo de manera literal en casi toda la UE, si bien cinco estados miembros no han indicado en sus respuestas a la Comisión que sus legislaciones nacionales requieran a los titulares de autorización de comercialización (TAC) que deben asegurar la continuidad del suministro en el mercado. Frente a ellos, otros han incluido provisiones adicionales, como Italia, que requiere a los TAC que suministren a las oficinas de farmacia con el producto desabastecido en el plazo de 48 horas.
Compras y medicamentos esenciales
La variabilidad continúa aumentando si se entra en otros terrenos. En primer lugar, si hablamos de penalizaciones. Están previstas en muchos países, si bien en la mayoría de los casos no se han aplicado en los últimos diez años. Frente a estos casos, ocho estados miembros no prevén el establecimiento de sanciones específicas por interrupciones de suministro.
En segundo lugar, las exportaciones paralelas. El que para Eslovaquia y otros países europeos más afectados es el gran culpable de los desabastecimientos se enfoca de manera muy distinta en la UE. Un total de 16 estados no incluyen restricciones específicas; frente a 11 que sí: en siete de ellos, es parte de una “obligación de servicio público”.
Las políticas de compras en la Unión Europea son otra pieza imprescindible del fragmentado mapa farmacéutico europeo. Las experiencias de los estados plantean diversas posibilidades a incluir en los contratos con los titulares de autorización de comercialización: informes periódicos de suministro; penalizaciones o selección de otro proveedor si el desabastecimiento persiste.
El capítulo de las divergencias se cierra con los fármacos esenciales. Cada país maneja su propio listado, basado en el de la OMS, pero 13 estados no contemplan medidas para estos productos, o para los considerados críticos desde el punto de vista de la garantía de suministro. Entre aquellos que sí, de nuevo la diversidad es la norma, si bien en este caso permite observar una amplia gama de posibles soluciones: desde los requerimientos básicos adicionales para el suministro de este tipo de medicamentos aprobados en Alemania hasta legislaciones específicas (Finlandia); pasando por reservas de almacenamiento (Noruega) u otro tipo de medidas regulatorias específicas (Francia, Eslovenia) que incluyen el pilotaje de un ‘árbol de decisión’ (Bélgica) para detectar de forma rápida problemas en el suministro.
Este abanico de acciones de los estados contra los desabastecimientos incluyen, además, acuerdos entre los agentes de la cadena; la garantía de información o el desarrollo de una guía de buenas prácticas (la de Reino Unido).