Los plazos de autorización de diferentes procedimientos de la Agencia Española de Medicamentos (Aemps) se han reducido significativamente durante el pasado año, a pesar de que se encuentran todavía muy lejos de los establecidos en la normativa. Así se recoge en un estudio elaborado por Merck, que analiza la evolución de los procedimientos que ha tenido con la Aemps durante los dos últimos años y que valora positivamente el Plan Estratégico General 2009-2012 de la Aemps.
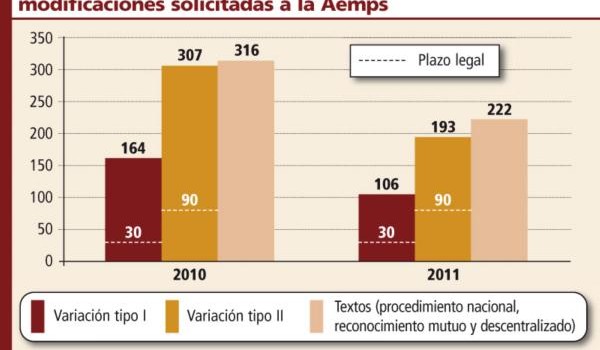
De este modo, en 2010 el plazo de aprobación de las variaciones tipo I era de 164 días, mientras que en 2011 se redujo hasta los 106 días, un 35 por ciento. Idéntico comportamiento se registró en las variaciones tipo II, que registraron en 2010 una demora de 307 días, 193 durante el año pasado.
Esta reducción de plazos ha sido muy bien valorada por las autoras del estudio Ana Céspedes, directora corporativa de Merck, y Anna Torrecillas, responsable de Excelencia y Mejora Continua de la compañía alemana. De este modo, destacan que la relevancia de la mejora en estos procedimientos es un “elemento clave para la competitividad” del sector, donde los tiempos de autorización y de lanzamiento son un “factor clave de éxito, tanto en el ámbito comercial, como en el de producción”.
Por ello, no es de extrañar que, según señala el estudio, en los últimos años hayan sido muchas las compañías las que han “trasladado esta necesidad a los distintos responsables técnicos y políticos de la agencia”. Por ese motivo, las autoras muestran su satisfacción por el esfuerzo realizado, tanto “por parte de sus responsables máximos como del equipo técnico altamente cualificado” que la integran.