Redacción
Madrid
Las compañías dedicadas a la investigación y fabricación de medicamentos huérfanos y ultra-huérfanos ya tienen una asociación que les respalde y que coordine sus movimientos colectivos. Así, la pasada semana tuvo lugar la presentación de la Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultra-Huérfanos (Aelmhu), que nace gracias a la cooperación de cinco compañías dedicadas a esta actividad: Orphan Europe, Swedish Orphan Biovitrum, Shire, Biomarin Europe y Alexion.
En este sentido, el director general de esta última, Jordi Casals, será el encargado de presidir la nueva patronal para intentar cumplir los objetivos fijados inicialmente. La junta directiva de Aelmhu se completa con los vicepresidentes Jordi Leal, director general de Orphan Europe, y Juan Ferrero, director general de Shire en nuestro país.
El presidente de la nueva asociación mencionó que los objetivos de la misma son “mejorar la situación y las necesidades de los pacientes afectados” por enfermedades raras. Asimismo, hizo referencia a la importancia de la constitución de Aelmhu, y destacó que “nace del fuerte compromiso de ayudar a hacer visibles la características especiales de las enfermedades raras y ultra-raras y sus tratamientos específicos”.
La labor de la patronal será coordinar las acciones de sus asociados ante las instituciones sanitarias, políticas y sociales, en cuanto a la difusión del conocimiento y de los beneficios que suponen los medicamentos huérfanos y ultra-huérfanos. Todo ello, dirigido a hacer llegar a los pacientes afectados por enfermedades raras los tratamientos de la manera más rápida y equitativa posible.
Designaciones huérfanas
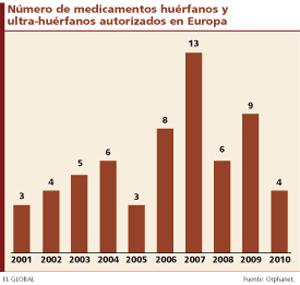
Desde 2001, según datos facilitados por Orphanet, un total de 61 medicamentos han sido designados como huérfanos por la Comisión Europea y comercializados bajo esta etiqueta para alguna indicación en al menos un país de la Unión Europea.
A este respecto, en la última década se han producido dos picos de designaciones de medicamentos huérfanos. En 2007, la Comisión Europea otorgó este estatus a 13 fármacos, mientras que en 2009, nueve moléculas pasaron a tener la designación de huérfano al menos para una indicación.
Asimismo, cabe destacar que de los 61 medicamentos que están autorizados en la Unión Europea para el tratamiento de alguna enfermedad rara y tienen la designación de medicamento huérfano, un total de 50 se comercializan en nuestro país y se encuentran financiados por el Sistema Nacional de Salud.